La radio-immunothérapie fait partie des nouveaux outils dont disposent les chercheurs pour lutter contre le cancer.
Traiter chaque patient en fonction des particularités génétiques et biologiques de sa tumeur, telles sont les nouvelles ambitions de la cancérologie. Une personnalisation qui semble aujourd’hui à portée de main, grâce à une panoplie de procédés thérapeutiques et doutils innovants.
Dans un rayon de quelques millimètres
Dans certains cas de cancer diffus comme le lymphome non hodgkinien (LNH ou cancer du système lymphatique) et notamment en cas de rechute après une chimiothérapie, la radio-immunothérapie est aujourd’hui proposée. « Cette thérapie ciblée utilise un anticorps antitumeur couplé à un radioélément », explique le professeur Françoise Kraeber-Bodéré, chef du service de médecine nucléaire au CHU de Nantes et à l’Institut de cancérologie de l’Ouest(1). Chaque anticorps est programmé naturellement pour reconnaître et se fixer sur un antigène, une molécule spécifique présente à la surface des cellules. « Aujourd’hui, nous sommes capables de cibler plusieurs antigènes identifiés comme spécifiques de certaines tumeurs grâce à des anticorps produits en laboratoire et liés à des éléments radioactifs. Ces derniers sont ainsi transportés par les anticorps au plus près des cellules tumorales qu’ils détruisent par irradiation dans un rayon de quelques millimètres. »
Identifier et cibler les antigènes
Avant d’envisager une telle thérapie, il convient de déterminer si le patient présente ces antigènes. « Dans le cas du LNH de type B, par exemple, nous savons que la grande majorité des patients présentent l’antigène CD20 à la surface de leurs cellules malignes. Pour détruire ces dernières, nous pouvons injecter un anticorps anti-CD20 associé à l’isotope radioactif yttrium 90. Ce traitement conduit à plus de 70 % de réponses objectives dans des formes “peu agressives” de LNH en rechute. » Pour l’heure, la radio-immunothérapie n’est pratiquée en France que pour le LNH de type B, mais des essais cliniques de phase 2 pour le cancer de la thyroïde et de phase 1 pour le cancer du poumon sont actuellement en cours à Nantes.
Imager pour mieux doser
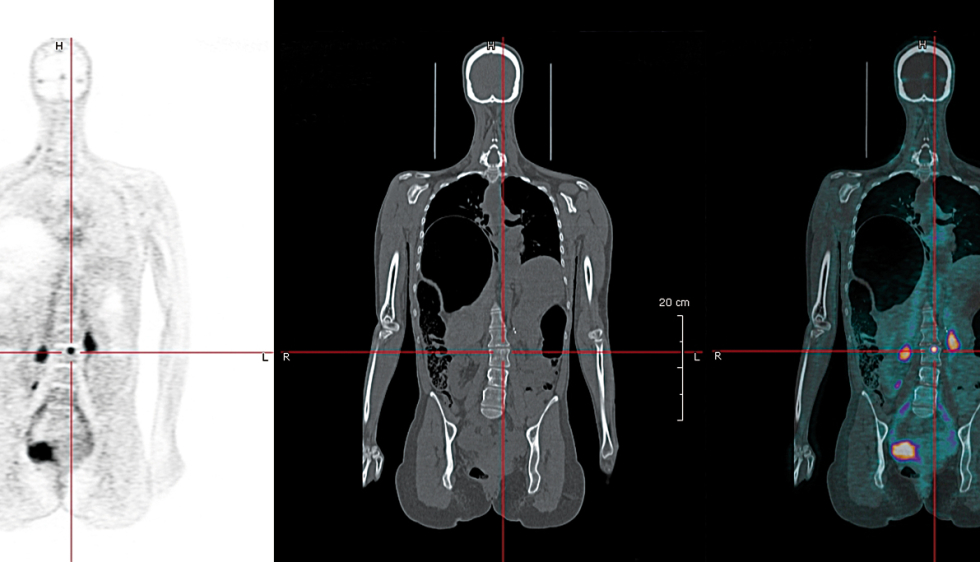
Pour améliorer la personnalisation du traitement, les médecins utilisent un autre outil révolutionnaire : la Tomographie par émission de positons (ou Tep, lire Comprendre ci-contre) permet de caractériser la tumeur, de suivre son évolution et donc l’efficacité du traitement. « Associer imagerie et traitement nous permet de voir comment et à quelle vitesse se distribue le médicament dans l’organe malade et d’adapter le dosage en fonction de nos observations. » Ni trop, ni trop peu !
Reste aujourd’hui à identifier d’autres antigènes, à mettre au point d’autres anticorps, d’autres radioéléments pour étendre ce type de traitement à davantage de tumeurs. Grâce au cyclotron Arronax qui produit de nouveaux radioéléments pour l’imagerie Tep ou les thérapies, et à la pluridisciplinarité de ses équipes de recherche, Nantes dispose désormais d’un arsenal à la pointe de la médecine nucléaire.
En direct du Centre Eugène-Marquis
Boucher les minuscules vaisseaux du foie malade grâce à l’injection dans l’artère hépatique de microbilles de verre radioactives (imprégnées d’yttrium 90), voici comment certains cancers du foie sont traités au Centre Eugène-Marquis de Rennes depuis 2006 (traitement TheraSphere®). « Hypervascularisée, la tumeur agit comme un aimant. Les billes y restent piégées, sans dommages pour la partie saine du foie », explique Évelyne Boucher, médecin oncologue.
Ciblé et bien toléré, ce traitement a un taux de réponse de l’ordre de 80 %. Il est le résultat de la volonté du Centre Eugène-Marquis de travailler en interdisciplinarité : médecine nucléaire, radiologie et oncologie. L’établissement rennais est celui qui traite le plus de patients en France. Et le 3e en Europe.
UNE TECHNIQUE D'IMAGERIE QUI EN DIT LONG
La Tomographie par émission de positons, ou Tep, est basée sur le principe de la scintigraphie. Cela consiste à injecter au patient une molécule radiomarquée, propre à une activité et /ou à un organe. Ce sont les deux photons émis par la désintégration de l’élément radioactif qui permettent de repérer la zone où s’est accumulé le marqueur.
Le marqueur le plus utilisé en oncologie est le FDG(2), un analogue du glucose marqué au fluor 18. Il a été choisi car le glucose renseigne sur le métabolisme des cellules. Étant donné que les cellules tumorales consomment de grandes quantités de glucose en raison de leur multiplication anarchique, le FDG s’y concentre.
La Tep permet donc de localiser précisément une tumeur et son éventuelle dispersion dans l’organisme. Mais elle donne aussi accès à l’intensité de l’activité du métabolisme et donc de l’activité tumorale.
(1)ICO-René Gauducheau à Saint-Herblain.
(2)Fluorodésoxyglucose (18F).
Françoise Kraeber-Bodéréfrancoise.bodere [at] chu-nantes.fr (
francoise[dot]bodere[at]chu-nantes[dot]fr)
TOUT LE DOSSIER
du magazine Sciences Ouest