Les précieux cristaux du vivant

Grâce à la cristallographie, les biologistes ont accès à la structure de molécules non cristallines : les protéines.
Elles sont grosses, repliées, compliquées. Formées d’un enchevêtrement d’acides aminés, eux-mêmes composés d’atomes divers, les protéines, briques essentielles au fonctionnement du vivant, semblent bien loin de la structure pure et ordonnée des cristaux. Et pourtant ! C’est bien grâce à la cristallographie que les chercheurs ont pu décrypter les mystères de ces macromolécules fascinantes.
S’inspirant des cristaux naturels, les scientifiques ont entrepris de produire des cristaux de protéines. Dans ces derniers, la maille élémentaire qui se répète contient des centaines de milliers d’atomes, car les molécules du vivant sont énormes ! C’est le travail réalisé par Mirjam Czjzek, spécialiste de la cristallographie du vivant, à la Station biologique de Roscoff(1).
Trouver la bonne vitesse
« Cristalliser les protéines est un véritable challenge, confie la scientifique. Il faut d’abord les concentrer, et souvent, nous avons peu de matière, car il est difficile d’isoler des protéines. Ensuite, il faut trouver les bonnes conditions pour qu’elles s’accrochent les unes aux autres de façon régulière. » Une étape délicate car ces molécules sont fragiles. Il est peu envisageable de jouer sur la température ou sur la pression comme pour les matériaux inertes. « Alors nous faisons comme pour le sel : lorsque vous dissolvez beaucoup de sel dans un verre d’eau, si vous attendez que l’eau s’évapore, vous allez voir apparaître les cristaux. Ici, nous mettons les protéines en sursaturation en mélange avec des sels et on favorise les interactions par évaporation. » Pour chaque protéine, il faut changer les concentrations, ajouter d’éventuels agents cristallisants qui vont faciliter les interactions, maîtriser l’évaporation pour que le processus soit suffisamment lent. « Si la vitesse n’est pas la bonne, on n’obtient pas un cristal, mais simplement un amas de protéines. » Et comme elles sont en petites quantités, les expériences ne se passent pas dans un verre, mais dans de minuscules gouttelettes en suspension au-dessus d’une coupelle de substrat. Un véritable travail d’équilibriste.
La 3D détermine la fonction
« J’utilise cette méthode pour étudier des enzymes, des protéines capables de découper les sucres qui forment la paroi des algues », précise la biologiste. Sujet de prédilection à Roscoff, une meilleure compréhension de ces enzymes pourrait mener à de nouveaux médicaments comme à des produits cosmétiques(2). La cristallographie est une étape indispensable, car, pour une protéine, la structure en 3D détermine la fonction. Comme Mirjam Czjzek est la seule à maîtriser ce savoir-faire en Bretagne, elle collabore également avec d’autres scientifiques. L’équipe dans laquelle travaille Olivier Delalande, physico-chimiste à l’Institut de génétique et développement de Rennes travaille en ce moment avec la biologiste. « Nous étudions la dystrophine, une protéine du corps humain. C’est elle qui est en cause dans certaines myopathies. » Dans ces maladies, le gène qui doit ordonner la construction de la dystrophine a subi une mutation. Il n’est plus capable d’ordonner la production de la protéine, ou alors de façon erronée. « Cela fait quinze ans que des chercheurs tentent de cristalliser la dystrophine. Mais c’est une grosse molécule et personne n’y est parvenu. »
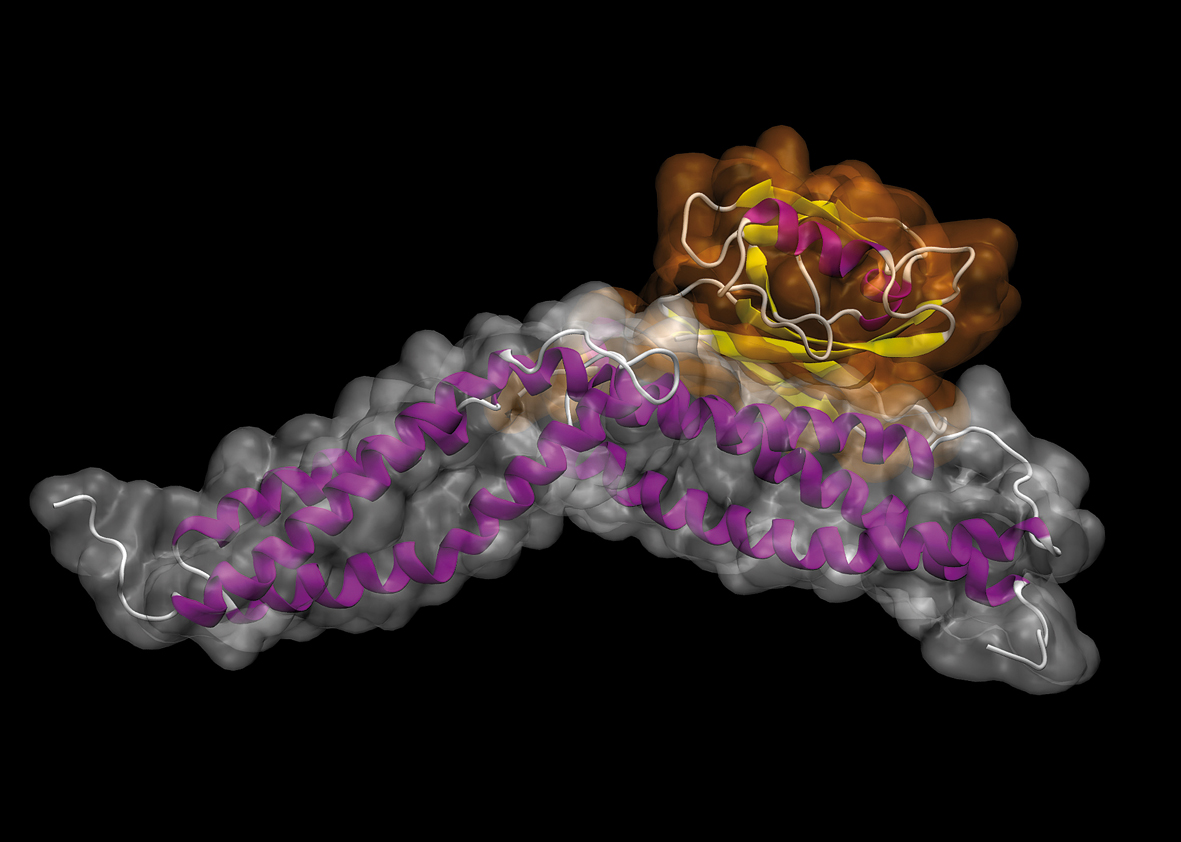
La structure de ce fragment de dystrophine
(en violet) a pu être mise au jour grâce à la
cristallographie.
© Olivier Delalande - IGOR
Les coudes de la protéine
Pour l’instant, seules les structures de certaines parties de la protéine ont été déterminées avec succès. « Alors nous cherchons d’autres moyens. Grâce à ces premiers morceaux, et avec d’autres informations, il a été établi que la dystrophine est composée de plusieurs segments qui ressemblent à une autre protéine plus petite, dont la structure est, elle, bien connue grâce à la cristallographie. En nous basant sur ce modèle, nous avons pu proposer un modèle quasi complet, une première mondiale ! » Grâce à une autre méthode, le projet a permis d’accéder à la forme générale de la protéine, son enveloppe extérieure en quelque sorte. « Et nous avons récemment montré que notre modèle se glissait parfaitement dans cette peau... » Plusieurs publications sont ainsi en préparation. « Nous avons notamment la confirmation que la dystrophine n’a pas une structure droite mais qu’elle présente des coudes. » Ce qui peut sembler du détail est pourtant fondamental. Grâce à ces coudes, on distingue différentes parties, et cela permettra peut-être de repérer les zones les plus impliquées dans la maladie. La collaboration avec Roscoff n’est pas terminée pour autant, comme le confirme Olivier Delalande : « Depuis plusieurs mois, Mirjam tente de faire pousser des cristaux avec des fragments de dystrophine. Et depuis quelques semaines, nous lui avons fourni un morceau de dystrophine accroché à une autre protéine. Nous espérons que ce complexe cristallisera plus facilement. » Si la méthode fonctionne, l’équipe pourra ajouter cette première mondiale à son palmarès.
(1)UMR CNRS - UPMC 8227.
(2)Lire Sciences Ouest n° 268 - septembre 2009.
Mirjam Czjzek Tél. 02 98 29 23 75
czjzek [at] sb-roscoff.fr (czjzek[at]sb-roscoff[dot]fr)
Olivier Delalande Tél. 02 23 23 30 07
olivier.delalande [at] univ-rennes1.fr (olivier[dot]delalande[at]univ-rennes1[dot]fr)
TOUT LE DOSSIER
du magazine Sciences Ouest






